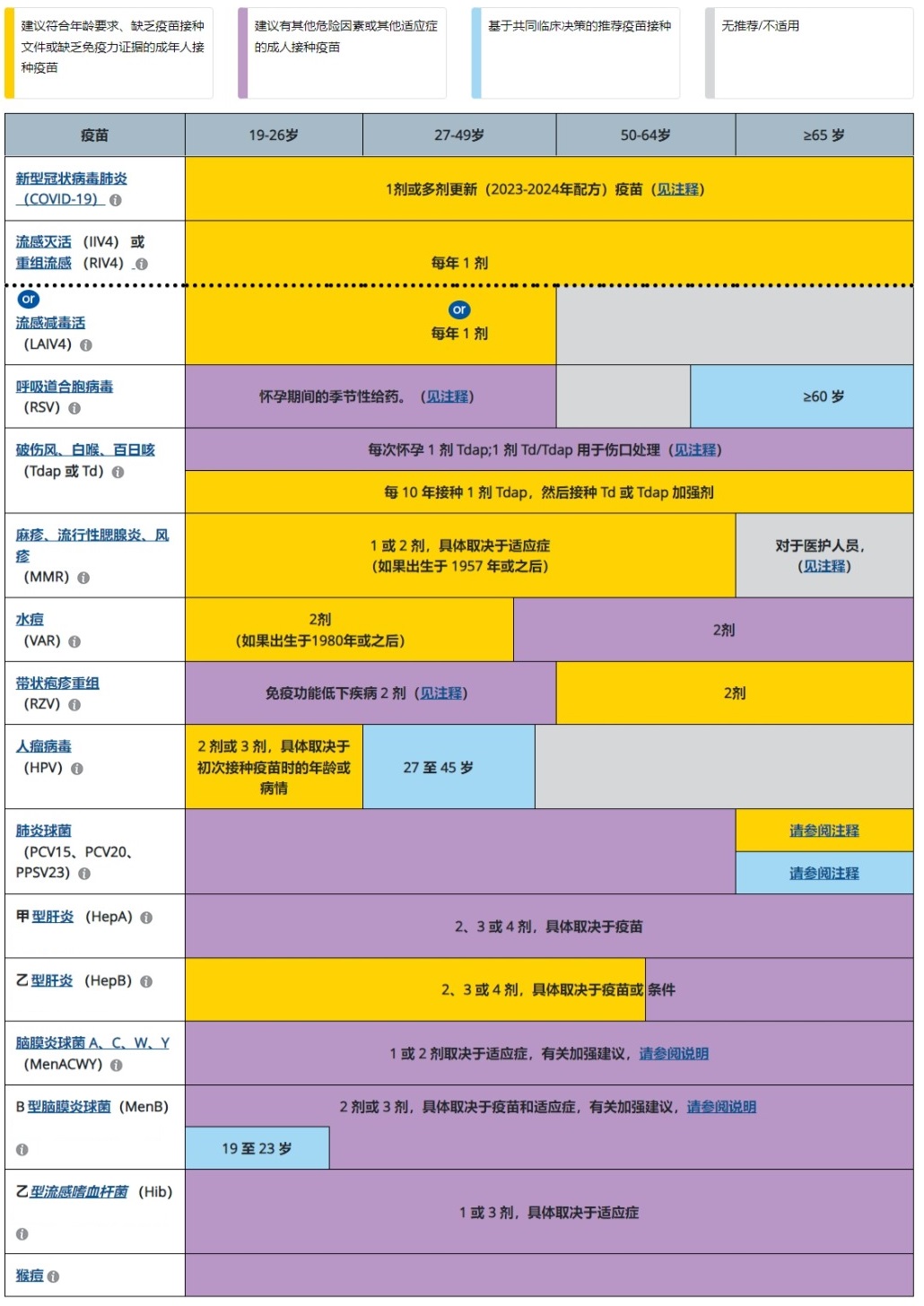
按年齡劃分的成人免疫接種計劃
2024 年針對 19 歲或以上人群的建議,美國
說明
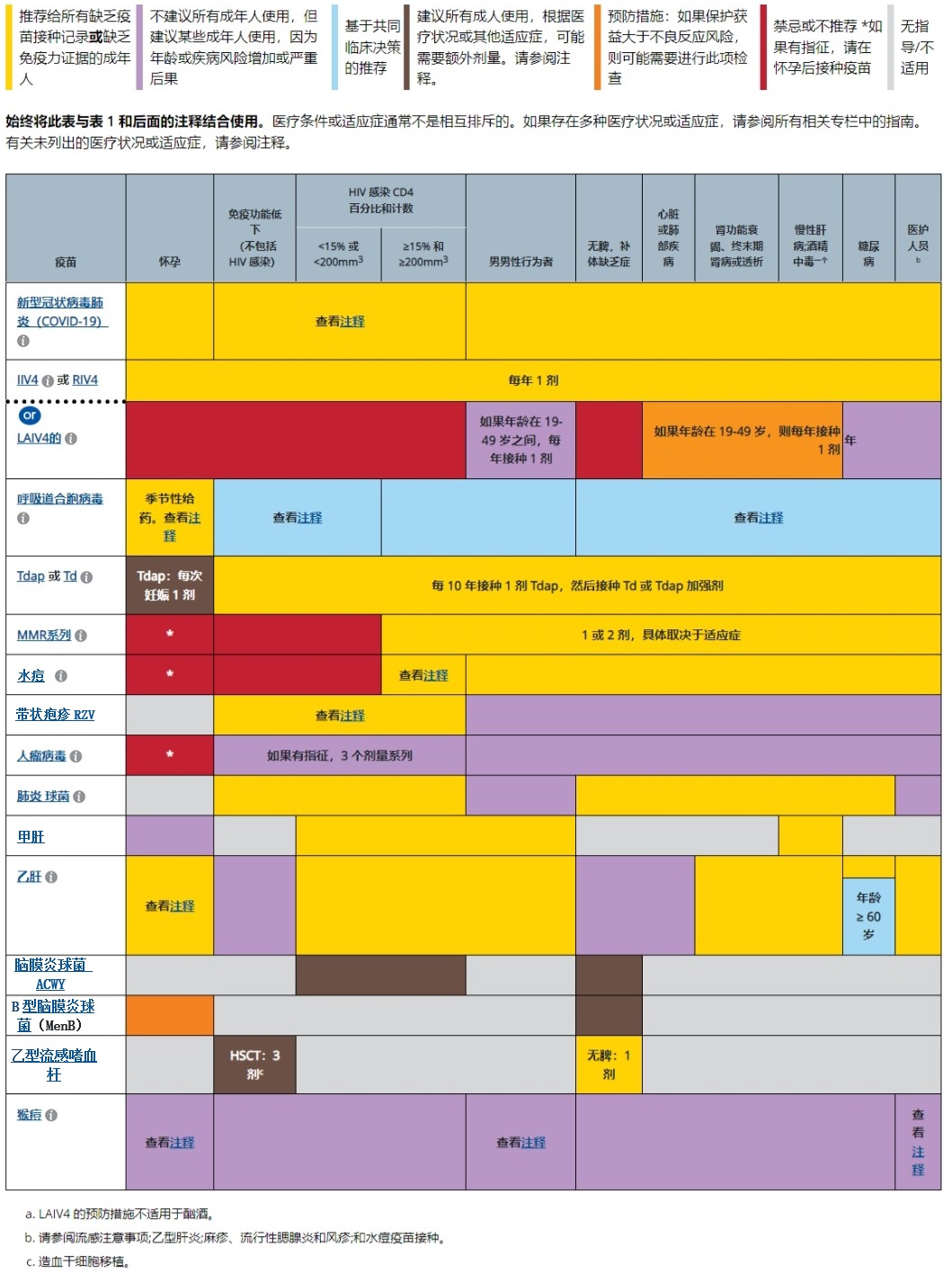
按醫療狀況和其他適應癥劃分的成人免疫接種時間表
說明
成人免疫接種計劃說明
- 為了計算劑量之間的間隔,4 周 = 28 天。≥4 個月的間隔由日歷月決定。
- 在數字范圍內(例如,12-18),短劃線 (–) 應讀作“至”。
- 在最低年齡或間隔前≤4 天接種的疫苗劑量被視為有效。在最低年齡或最短間隔≥5天之前接種的任何疫苗劑量不應被視為有效,應重復接種。重復劑量應在無效劑量之后間隔建議的最小間隔。
COVID-19 疫苗接種
常規疫苗接種
年滿 19 歲
- 未接種疫苗:
- 1 劑更新(2023-2024 年配方)Moderna 或 Pfizer-BioNTech 疫苗
- 2 劑系列更新(2023-2024 年配方)Novavax 在 0、3-8 周時
- 之前接種過1劑或多劑任何COVID-19疫苗*:在最近一劑 COVID-19 疫苗后至少 8 周接種 1 劑任何更新的(2023-2024 年配方)COVID-19 疫苗。
特殊情況
中度或重度免疫功能低下者**
- 未接種疫苗:
- 0、4、8 周時更新(2023-2024 年配方)Moderna 的 3 劑系列
- 0、3、7 周時更新(2023-2024 年配方)輝瑞-BioNTech 的 3 劑系列
- 2劑系列更新(2023-2024 年配方)Novavax 在 0、3 周時
- 之前接種過1劑任何Moderna*:2 劑更新(2023-2024 年配方)Moderna 系列,接種 0、4 周(前一劑 Moderna 劑量和第 1 劑之間的最小間隔:4 周)
- 之前接種過2劑任何Moderna疫苗*:最近一劑后至少 4 周接種 1 劑更新的(2023-2024 年配方)Moderna。
- 之前接種過1劑任何輝瑞-BioNTech疫苗*:在 0、4 周時接種 2 劑更新(2023-2024 年配方)輝瑞-BioNTech 系列疫苗(之前的輝瑞-BioNTech 劑量和第 1 劑之間的最小間隔:3 周)。
- 之前接種過 2 劑任何輝瑞-BioNTech疫苗*:在最近一劑后至少 4 周接種 1 劑更新(2023-2024 年配方)輝瑞-BioNTech。
- 之前接種過 3 劑或更多劑任何Moderna或Pfizer-BioNTech疫苗*:在最近一劑后至少 8 周接種 1 劑任何更新的(2023-2024 年配方)COVID-19 疫苗。
- 之前接種過1劑或多劑Janssen或Novavax,有或沒有任何原始單價或二價COVID-19疫苗的劑量:在最近一劑后至少 8 周接種 1 劑任何更新的(2023-2024 年配方)COVID-19 疫苗。
當有不止一種推薦的適齡疫苗可用時,沒有優先推薦使用一種COVID-19疫苗而不是另一種疫苗。
*注意:先前接種疫苗定義為在更新的 2023-2024 年配方之前接種過任何原始單價或二價 COVID-19 疫苗(楊森、莫德納、諾瓦瓦克斯、輝瑞-BioNTech)。
**注意:中度或重度免疫功能低下的人可以選擇在最后一次推薦的更新(2023-2024 年配方)COVID-19 疫苗劑量后至少 2 個月再接種一劑更新的(2023-2024 年配方)COVID-19 疫苗。根據醫療保健提供者的臨床判斷以及個人偏好和情況,可以進一步額外更新(2023-2024 年公式)接種 COVID-19 疫苗劑量。任何進一步的額外劑量應在上次更新(2023-2024 年公式)COVID-19 疫苗劑量后至少 2 個月接種。
乙型流感嗜血桿菌疫苗接種
特殊情況
- 解剖或功能性無脾(包括鐮狀細胞病):如果以前未接種過 Hib 疫苗,則為 1 劑;如果選擇性脾切除術,最好在脾切除術前至少 14 天接種 1 劑。
- 造血干細胞移植 (HSCT):移植成功后 6-12 個月開始,間隔 4 周進行 3 劑系列,無論是否有 Hib 疫苗接種史。
甲型肝炎疫苗接種
常規疫苗接種
- 任何未完全接種疫苗并要求接種疫苗的人(不需要確定危險因素):2 劑系列 HepA(Havrix 間隔 6-12 個月或 Vaqta 間隔 6-18 個月 [最短間隔:6 個月])或 3 劑系列 HepA-HepB(Twinrix 在 0、1、6 個月時 [最小間隔:第 1 劑至第 2 劑:4 周/第 2 劑至第 3 劑: 5個月])
特殊情況
- 任何未完全接種疫苗且有甲型肝炎病毒感染風險的人:如上所述,2 劑系列 HepA 或 3 劑系列 HepA-HepB。甲型肝炎病毒感染的危險因素包括
- 慢性肝病(例如乙型肝炎、丙型肝炎、肝硬化、脂肪肝、酒精性肝病、自身免疫性肝炎、丙氨酸轉氨酶 [ALT] 或天冬氨酸轉氨酶 [AST] 水平高于正常上限兩倍的人)
- HIV感染
- 男男性行為者
- 注射或非注射吸毒
- 無家可歸者
- 在研究實驗室中處理甲型肝炎病毒或與感染甲型肝炎病毒的非人靈長類動物一起工作
- 在甲型肝炎高或中流行國家旅行(HepA-HepB [Twinrix] 可在 0、7 和 21-30 天按 3 劑的加速計劃給藥,然后在 12 個月時接種加強劑)
- 在從甲型肝炎高或中度地方性肝炎國家抵達后的前 60 天內與國際被收養者(例如,家庭或常規保姆)進行密切的個人接觸(計劃在收養后立即接種第 1 劑,至少在被收養者抵達前 2 周)
- 如果懷孕期間有感染風險或感染的嚴重后果,則懷孕
- 接觸環境,包括針對注射或非注射吸毒者服務的衛生保健環境,或為發育障礙者提供的集體之家和非住宿日托設施(不需要個人危險因素篩查)
乙型肝炎疫苗接種
常規疫苗接種
- 19 至 59 歲:完成 2 劑、3 劑或 4 劑系列接種
- 2 劑系列僅適用于間隔至少 4 周使用 2 劑 Heplisav-B† 的情況
- 0、1、6 個月時的 3 劑系列 Engerix-B、PreHevbrio† 或 RecombivaxHB [最小間隔:第 1 劑至第 2 劑:4 周/第 2 劑至第 3 劑:8 周/第 1 劑至第 3 劑:16 周])
- 3 劑系列 HepA-HepB(0、1、6 個月時的 Twinrix[最小間隔:第 1 劑至第 2:4 周/第 2 劑至第 3 劑:5 個月])
- 4 劑系列 HepA-HepB (Twinrix) 加速了 0、7 和 21-30 天的 3 劑計劃,然后在 12 個月時加強劑量
†注意:由于缺乏孕婦的安全數據,不建議在懷孕期間使用Heplisav-B和PreHevbrio。
- 60歲或以上且無已知乙型肝炎病毒感染危險因素的人群可接種乙肝系列疫苗。
- 60歲或以上且已知有乙型肝炎病毒感染危險因素的人群應接種乙肝系列疫苗。
- 任何 60 歲或以上的成年人如果要求接種乙肝疫苗,都應接種乙肝疫苗系列。
- 乙型肝炎病毒感染的危險因素包括:
- 慢性肝病,例如丙型肝炎、肝硬化、脂肪肝、酒精性肝病、自身免疫性肝炎、丙氨酸轉氨酶 (ALT) 或天冬氨酸轉氨酶 (AST) 水平高于正常上限兩倍的人
- HIV感染
- 性暴露風險(例如,乙型肝炎表面抗原 (HBsAg) 陽性者的性伴侶、非一夫一妻制關系中的性活躍者、尋求性傳播感染評估或治療的人、男男性行為者)
- 當前或近期注射吸毒
- 經皮或粘膜暴露于血液的風險,例如,HBsAg陽性者的家庭接觸者;發育障礙者設施的居民和工作人員;有合理預期暴露于血液或受血液污染的體液風險的衛生保健和公共安全人員;接受維持性透析的人士(包括中心或居家血液透析及腹膜透析)、透析前人士及糖尿病患者*
- 監禁
- 在乙型肝炎高流行或中流行國家旅行
- 乙型肝炎病毒感染的危險因素包括:
*60 歲或以上患有糖尿病:基于共同的臨床決策,2、3 或 4 劑系列如上所述。
特殊情況
- 透析患者:完成 3 劑或 4 劑系列治療
- 0、1、6 個月時的 3 劑系列 Recombivax HB(注意:使用透析配方 1 mL = 40 mcg)
- 0、1、2 和 6 個月時的 4 劑系列 Engerix-B(注意:使用 2 mL 劑量代替 1 mL 的正常成人劑量)
人瘤病毒疫苗接種
常規疫苗接種
- 所有26歲以下的人:2 劑或 3 劑系列,具體取決于初次接種疫苗的年齡或病情
- 初次接種疫苗時年齡在 9-14 歲之間,接種 1 劑或 2 劑,間隔不到 5 個月:再接種 1 劑
- 初次接種疫苗時年齡在9-14歲之間,間隔至少5個月接種2劑:HPV 疫苗接種系列完成,無需額外劑量
- 初次接種疫苗時年滿15歲:0、1-2 個月、6 個月時接種 3 劑系列(最短間隔:第 1 劑至第 2 劑:4 周/第 2 劑至第 3 劑:12 周/第 1 劑至第 3 劑:5 個月;如果過早給藥,則重復給藥)
- 當使用推薦的給藥間隔完成任何化合價的任何 HPV 疫苗系列時,不建議額外劑量。
共享臨床決策
- 27-45 歲的成年人:根據共同的臨床決策,完成 2 劑系列(如果開始 9-14 歲)或 3 劑系列(如果開始≥15 歲)
特殊情況
- 上述推薦的常規和補種疫苗接種或共同臨床決策的年齡范圍也適用于特殊情況
- 免疫功能低下的情況,包括 HIV 感染:3 劑系列接種,即使是在 9 至 14 歲時開始接種疫苗的人。
- 懷孕:接種疫苗前不需要妊娠試驗;不建議在懷孕后接種HPV疫苗;如果在懷孕期間無意中接種了疫苗,則無需干預。
接種流感疫苗
常規疫苗接種
- 19 歲或以上:每年接種 1 劑適合年齡和健康狀況的流感疫苗。
- 65歲或以上:四價高劑量滅活流感疫苗(HD-IIV4)、四價重組流感疫苗(RIV4)或四價佐劑滅活流感疫苗(aIIV4)中的任意一種是首選。如果這三種疫苗都不可用,則應使用任何其他適合年齡的流感疫苗。
特殊情況
- 需要受保護環境的嚴重免疫抑制者的密切接觸者(例如護理人員、醫護人員):不應接受 LAIV4。如接種LAIV4,應在接種后7天內避免接觸/照顧該等免疫抑制人士 vaccination.is 接種疫苗后7天內應避免接觸/照顧該等免疫抑制人士。
注意:對雞蛋過敏的人可以接種任何適合年齡和健康狀況的流感疫苗(以雞蛋為基礎和非以雞蛋為基礎)。
麻疹、流行性腮腺炎和風疹疫苗接種
常規疫苗接種
- 無對麻疹、腮腺炎或風疹有免疫力的證據:1劑
- 免疫力的證據:1957 年以前出生(醫護人員除外,見下文)、接種 MMR 疫苗的文件、免疫或疾病的實驗室證據(未經實驗室確認的疾病診斷不是免疫力的證據)
特殊情況
- 沒有風疹免疫證據的懷孕:懷孕期間禁用MMR;懷孕后(從醫療機構出院前),1劑
- 無風疹免疫證據的非懷孕育齡人士:1劑
- CD4 百分比為 ≥15% 且 CD4 計數≥200 個細胞/mm3 的 HIV 感染至少 6 個月,且無對麻疹、流行性腮腺炎或風疹免疫的證據:至少間隔 4 周的 2 劑系列接種;MMR 禁忌用于 CD4 百分比<15% 或 CD4 計數<200 個細胞/mm 的 HIV 感染3
- 嚴重免疫功能低下疾病:MMR 禁忌
- 高等教育機構的學生、國際旅行者以及沒有麻疹、腮腺炎或風疹免疫力證據的免疫功能低下者的家庭或密切接觸者:如果以前沒有接受過任何劑量的 MMR,則間隔至少 4 周接種 2 劑系列疫苗,如果之前接受過 1 劑 MMR,則間隔 1 劑
- 醫護人員:
- 1957 年之前出生,沒有證據表明對麻疹、腮腺炎或風疹有免疫力:考慮至少間隔 4 周接種 2 劑以預防麻疹或流行性腮腺炎,或接種 1 劑以預防風疹
- 出生于 1957 年或之后,沒有證據表明對麻疹、腮腺炎或風疹具有免疫力:至少間隔 4 周接種 2 劑以預防麻疹或流行性腮腺炎,或至少接種 1 劑以預防風疹
腦膜炎球菌疫苗接種
MenACWY的特殊情況
- 解剖學或功能性無脾(包括鐮狀細胞病)、HIV 感染、持續補體成分缺乏、補體抑制劑(例如依庫珠單抗、ravulizumab) 使用:2 劑系列 MenACWY(Menveo 或 MenQuadfi)至少間隔 8 周,如果風險仍然存在,每 5 年重新反應一次
- 在高流行性或流行性腦膜炎球菌病國家旅行,或經常暴露于腦膜炎奈瑟菌的微生物學家:1 劑 MenACWY(Menveo 或 MenQuadfi),如果風險仍然存在,每 5 年重新接種一次
- 住在住宅的一年級大學生(如果之前在 16 歲或以上之前沒有接種疫苗)或新兵:1 劑 MenACWY(Menveo 或 MenQuadfi)
- 有關“特殊情況”下所列群體和暴發環境中(例如,在社區或組織環境中,或在男男性行為者中)的MenACWY加強劑量建議以及其他腦膜炎球菌疫苗接種信息
MenB 的共同臨床決策
- 16-23 歲(首選 16-18 歲)的青少年和年輕人,腦膜炎球菌病風險不增加:基于共同的臨床決策,2 劑系列 MenB-4C (Bexsero) 至少相隔 1 個月或 2 劑系列 MenB-FHbp (Trumenba) 在 0、6 個月時(如果第 2 劑在第 1 劑后不到 6 個月給藥,則在第 2 劑后至少 4 個月給藥第 3 劑);MenB-4C 和 MenB-FHbp 不可互換(系列所有劑量使用同一產品)
MenB的特殊情況
- 解剖學或功能性無脾(包括鐮狀細胞病)、持續補體成分缺乏、補體抑制劑(例如依庫珠單抗、ravulizumab)的使用,或微生物學家常規暴露于腦膜炎奈瑟菌:2 劑初級系列 MenB-4C (Bexsero) 至少間隔 1 個月或 3 劑初級系列 MenB-FHbp (Trumenba) 在 0、1-2、6 個月時(如果第 2 劑在第 1 劑后至少 6 個月給藥, 不需要劑量 3;如果第 3 劑在第 2 劑后 4 個月內給藥,則應在第 3 劑后至少 4 個月給藥第四劑);MenB-4C 和 MenB-FHbp 不可互換(系列所有劑量使用相同的產品);初次系列后 1 年接種 1 劑 MenB 加強劑,如果風險仍然存在,每 2-3 年重新接種一次
- 懷孕:將 MenB 推遲到懷孕后,除非風險增加且疫苗接種益處大于潛在風險
注意:如果有指征,MenB 疫苗可以與 MenACWY 疫苗同時接種,但如果可行,可以在不同的解剖部位接種。
成人可以接受單劑量的Penbraya™作為 MenACWY 和 MenB 單獨給藥的替代方法,當兩種疫苗將在同一門診日接種時。對于沒有增加風險的成年人,如果 Penbraya™用于第 1 劑 MenB,MenB-FHbp (Trumenba) 應用于第 2 劑 MenB。對于腦膜炎球菌病風險增加的成年人,Penbraya™可用于額外的 MenACWY 和 MenB 劑量(包括加強劑量),如果兩者將在同一門診日給藥,并且自最近一次 Penbraya 以來至少已經過去了 6 個月™劑量。
猴痘疫苗接種
特殊情況
- 任何有猴痘感染風險的人:2 劑系列,間隔 28 天。
猴痘感染的危險因素包括:- 男同性戀、雙性戀和其他男男性行為者、跨性別者或非二元性別者在過去 6 個月內有:
- 至少 1 種性傳播疾病的新診斷
- 超過1個性伴侶
- 在商業性場所發生性行為
- 在發生猴痘傳播的地理區域內與大型公共活動相關的性行為
- 與上述人員有性伴侶的人。
- 預計會遇到上述任何情況的人。
- 男同性戀、雙性戀和其他男男性行為者、跨性別者或非二元性別者在過去 6 個月內有:
- 懷孕:由于缺乏孕婦的安全性數據,目前沒有ACIP建議在懷孕期間使用Jynneos。具有上述任何危險因素的孕婦可以接受 Jynneos。
- 醫護人員:除極少數情況(例如沒有可用的個人防護設備)外,沒有上述任何性危險因素的醫護人員不應接受 Jynneos。
肺炎球菌疫苗接種
常規疫苗接種
- 年滿 65 歲且有以下條件:
- 以前未接種過一劑PCV13、PCV15或 PCV20 或既往疫苗接種史不明:1 劑 PCV15 或 1 劑 PCV20。
- 如果使用 PCV15,則在 PCV15 劑量后至少 1 年給予 1 劑 PPSV23(對于免疫功能低下、* 人工耳蝸或腦脊液滲漏的成年人,可至少間隔 8 周)。
- 以前只收到PCV7:遵循上述建議。
- 以前只接受過PCV13:1 劑 PCV20 或 1 劑 PPSV23。
- 如果選擇 PCV20,則在最后一次 PCV13 劑量后至少 1 年給藥。
- 如果選擇 PPSV23,則在最后一次 PCV13 給藥后至少 1 年給藥(對于免疫功能低下、* 人工耳蝸植入或腦脊液滲漏的成年人,可至少間隔 8 周)。
- 以前只接受過 PPSV23:1 劑 PCV15 或 1 劑 PCV20。在最后一次 PPSV23 劑量后至少 1 年接種 PCV15 或 PCV20。
- 如果使用 PCV15,則不建議額外接種 PPSV23 劑量。
- 既往接種過PCV13和PPSV23,但在65 歲或以上時未接種 PPSV23:1 劑 PCV20 或 1 劑 PPSV23。
- 如果選擇 PCV20,則在最后一次肺炎球菌疫苗劑量后至少 5 年接種。
- 既往接種過PCV13和PPSV23,并且在65歲或以上時接種了PPSV23:根據共同的臨床決策,在最后一劑肺炎球菌疫苗后至少 5 年接種 1 劑 PCV20。
- 以前未接種過一劑PCV13、PCV15或 PCV20 或既往疫苗接種史不明:1 劑 PCV15 或 1 劑 PCV20。
特殊情況
- 年齡在 19-64 歲之間,患有某些基礎疾病或其他風險因素**,并且有:
- 以前未接種過 PCV13、PCV15 或 PCV20 或既往疫苗接種史不明:1 劑 PCV15 或 1 劑 PCV20。
- 如果使用 PCV15,則在 PCV15 劑量后至少 1 年給予 1 劑 PPSV23(對于免疫功能低下、* 人工耳蝸或腦脊液滲漏的成年人,可至少間隔 8 周)。
- 以前只收到PCV7:遵循建議
- 以前只接受過 PCV13:1 劑 PCV20 或 1 劑 PPSV23。
- 如果選擇 PCV20,則在 PCV13 劑量后至少 1 年給藥。
- 以前只接受過 PPSV23:1 劑 PCV15 或 1 劑 PCV20。在最后一次 PPSV23 劑量后至少 1 年接種 PCV15 或 PCV20。
- 如果使用 PCV15,則不建議額外接種 PPSV23 劑量。
- 既往接受過 PCV13 和 1 劑 PPSV23:1 劑 PCV20 或 1 劑 PPSV23。
- 如果選擇 PCV20,則在最后一次肺炎球菌疫苗劑量后至少 5 年接種。
- 以前未接種過 PCV13、PCV15 或 PCV20 或既往疫苗接種史不明:1 劑 PCV15 或 1 劑 PCV20。
*注意:免疫功能低下疾病包括慢性腎功能衰竭、腎病綜合征、免疫缺陷、醫源性免疫抑制、全身性惡性腫瘤、HIV 感染、霍奇金病、白血病、淋巴瘤、多發性骨髓瘤、實體器官移植、先天性或獲得性無脾、鐮狀細胞病或其他血紅蛋白病。
**注意:基礎疾病或其他危險因素包括酗酒、慢性心臟/肝臟/肺病、慢性腎功能衰竭、吸煙、人工耳蝸、先天性或后天性無脾、腦脊液滲漏、糖尿病、全身惡性腫瘤、HIV 感染、霍奇金病、免疫缺陷、醫源性免疫抑制、白血病、淋巴瘤、多發性骨髓瘤、腎病綜合征、實體器官移植或鐮狀細胞病或其他血紅蛋白病。
脊髓灰質炎病毒疫苗接種
常規疫苗接種
- 已知或疑似未接種疫苗或未完全接種疫苗的成年人:接種剩余劑量(1、2 或 3 劑 IPV)以完成 3 劑初級系列接種。 除非有具體理由相信他們沒有接種疫苗,否則大多數在美國出生和長大的成年人可以假設他們小時候接種過脊髓灰質炎疫苗。
*注意:完整的初級系列包括至少 3 劑 IPV 或三價口服脊髓灰質炎病毒疫苗 (tOPV) 的任意組合。
特殊情況
- 完成初級系列研究的脊髓灰質炎病毒暴露風險增加的成年人*:可終生接種一次滅活脊髓灰質炎疫苗加強針
*注意:完整的初級系列包括至少 3 劑 IPV 或三價口服脊髓灰質炎病毒疫苗 (tOPV) 的任意組合。
呼吸道合胞病毒疫苗接種
常規疫苗接種
- 在美國大陸大部分地區,9 月至 1 月妊娠 32-36 周時懷孕*:接種 1 劑 RSV 疫苗(Abrysvo™).無論既往是否感染過 RSV,都應接種 RSV 疫苗。
- 建議母親接種 RSV 疫苗或嬰兒接種 nirsevimab(RSV 單克隆抗體),以預防嬰兒呼吸道合胞病毒下呼吸道感染。
- 所有其他孕婦:不建議接種 RSV 疫苗
目前沒有ACIP建議在隨后的妊娠中接種RSV疫苗。沒有數據可以告知以后妊娠是否需要額外劑量。
*注意:RSV 季節性與美國大陸大部分地區不同的司法管轄區(例如,阿拉斯加、熱帶氣候司法管轄區)的提供者應遵循公共衛生當局(例如 CDC、衛生部門)或區域醫療中心關于基于當地 RSV 季節性的給藥時機的指導。請參閱 2024 年兒童和青少年免疫接種計劃,了解有關嬰兒使用奈司韋單抗的注意事項。
特殊情況
- 60歲或以上:基于共同的臨床決策,1 劑 RSV 疫苗(Arexvy 或 Abrysvo®™).最有可能從疫苗接種中受益的人是那些被認為患嚴重 RSV 疾病風險增加的人。
**注意:60 歲或以上的成人患嚴重 RSV 疾病的風險增加,包括患有慢性疾病的人,例如肺部疾病(例如慢性阻塞性肺疾病、哮喘)、心血管疾病(例如充血性心力衰竭、冠狀動脈疾病)、神經系統或神經肌肉疾病、腎臟疾病、肝臟疾病、血液系統疾病、糖尿病以及中度或重度免疫功能低下(可歸因于醫療狀況或接受免疫抑制藥物或治療);那些被認為是虛弱的人;高齡者;居住在療養院或其他長期護理機構的人;以及那些患有其他基礎疾病或醫務人員確定的因素可能會增加患嚴重呼吸系統疾病風險的人。
破傷風、白喉和百日咳 (Tdap) 疫苗接種
常規疫苗接種
- 以前在 11 歲或之后未接受 Tdap*:1 劑 Tdap,然后每 10 年 Td 或 Tdap
*注意:在 10 歲時服用 Tdap 可計為 11-12 歲時推薦的青少年劑量
特殊情況
- 以前沒有接受過破傷風、白喉或百日咳的初級疫苗接種系列:至少 4 周后接種 1 劑 Tdap 后接種 1 劑 Td 或 Tdap,6-12 個月后接種第三劑 Td 或 Tdap(首選 Tdap 作為第一劑,可替代任何 Td 劑量)、Td 或 Tdap,此后每 10 年接種一次。
- 妊娠:每次妊娠期間服用 1 劑 Tdap,最好在妊娠 27-36 周的早期。
- 傷口處理:接種 3 劑或以上含破傷風類毒素疫苗的人:對于干凈和輕微的傷口,如果距離最后一劑含破傷風類毒素疫苗超過 10 年,則接種 Tdap 或 Td;對于所有其他傷口,如果自上次接種含破傷風類毒素疫苗以來超過 5 年,則給予 Tdap 或 Td。對于以前未接受過 Tdap 或 Tdap 病史不明的人,首選 Tdap。如果孕婦需要接種含破傷風類毒素的疫苗,請使用 Tdap。
*注意:在 10 歲時服用 Tdap 可算作 11-12 歲時推薦的青少年劑量。
水痘疫苗接種
常規疫苗接種
- 無水痘免疫證據:如果之前未接種含水痘疫苗(兒童 VAR 或 MMRV [麻疹-腮腺炎-風疹-水痘疫苗]),則間隔 4-8 周接種 2 劑系列疫苗;如果之前接種過 1 劑含水痘疫苗,則在首次接種后至少 4 周接種 1 劑
- 免疫力的證據:1980 年之前在美國出生(孕婦和醫護人員除外 [見下文]),間隔至少 4 周接種 2 劑含水痘疫苗的文件,醫療保健提供者診斷或驗證水痘或帶狀皰疹病史,免疫或疾病的實驗室證據
特殊情況
- 沒有水痘免疫證據的懷孕:妊娠期間禁用VAR;懷孕后(從醫療機構出院前),如果之前接種過 1 劑含水痘疫苗,則接種 1 劑,如果之前未接種過任何含水痘疫苗,則接種 1 劑(第 2 劑:4-8 周后),無論是否在 1980 年之前出生在美國。
- 沒有水痘免疫證據的醫務人員:如果之前接種過 1 劑含水痘疫苗,則接種 1 劑;如果以前沒有接種過任何含水痘的疫苗,則間隔 4-8 周接種 2 劑系列,無論是否在 1980 年之前出生。
- HIV 感染,CD4 百分比為 ≥15%,CD4 計數≥200 個細胞/mm3沒有免疫力的證據:可以考慮接種疫苗(間隔 3 個月接種 2 劑);VAR 禁忌用于 CD4 百分比 <15% 或 CD4 計數<200 個細胞/mm 的 HIV 感染3
- 嚴重的免疫功能低下疾病:VAR禁忌。
帶狀皰疹疫苗接種
常規疫苗接種
- 年齡 50 歲或以上*:2 劑系列重組帶狀皰疹疫苗(RZV、Shingrix)間隔 2-6 個月(最短間隔:4 周;如果過早接種,則重復給藥),無論既往是否患有帶狀皰疹或帶狀皰疹疫苗活(ZVL、Zostavax)疫苗接種史。
*注意:既往水痘的血清學證據不是帶狀皰疹疫苗接種的必要條件。但是,如果獲得水痘易感性的血清學證據,提供者應首先遵循 ACIP 水痘疫苗接種指南。RZV不適用于預防水痘,關于在沒有水痘或水痘疫苗接種史的人中使用RZV的數據有限。
特殊情況
- 懷孕:目前尚無ACIP對妊娠期使用RZV的建議。考慮將RZV推遲到懷孕后。
- 免疫功能低下的情況(包括 HIV 感染者,無論 CD4 計數如何)**:2 劑系列重組帶狀皰疹疫苗(RZV、Shingrix)間隔 2-6 個月(最短間隔:4 周;如果過早給藥,則重復給藥)。
成人免疫接種時間表附錄
COVID-19 和流感疫苗
|
成人疫苗時間表附錄 |
||
|---|---|---|
|
疫苗 |
禁忌或不推薦1 |
預防 措施2 |
|
COVID-19 mRNA 疫苗 |
|
|
|
COVID-19 蛋白亞單位疫苗 |
|
|
|
流感,基于雞蛋,滅活注射劑 (IIV4) |
|
|
|
基于細胞培養的滅活注射劑 |
|
|
|
重組注射液 (RIV4) |
|
|
|
減毒活流感 (LAIV4) |
|
|
其他疫苗
|
成人疫苗時間表附錄 |
||
|---|---|---|
|
疫苗 |
禁忌或不推薦1 |
預防 措施2 |
|
乙型流感嗜血桿菌(Hib) |
|
|
|
甲型肝炎 (HepA) |
|
|
|
乙型肝炎 (HepB) |
|
|
|
甲型肝炎-乙型肝炎疫苗 (HepA-HepB) |
|
|
|
人瘤病毒(HPV) |
|
|
|
麻疹、流行性腮腺炎、風疹 (MMR) |
|
|
|
腦膜炎球菌 ACWY (MenACWY) |
|
|
|
腦膜炎球菌 B (MenB) |
|
|
|
腦膜炎球菌 ABCWY |
|
|
|
猴痘 [Jynneos] |
|
|
|
肺炎球菌偶聯物(PCV15、PCV20) |
|
|
|
肺炎球菌多糖(PPSV23) |
|
|
|
滅活脊髓灰質炎病毒疫苗 (IPV) |
|
|
|
呼吸道合胞病毒疫苗(RSV) |
|
|
|
破傷風、白喉和無細胞百日咳 (Tdap) |
|
|
|
水痘 (VAR) |
|
|
|
帶狀皰疹重組疫苗(RZV) |
|
|
- 當存在禁忌癥時,不應接種疫苗。
- 當采取預防措施時,通常應推遲疫苗接種,但如果疫苗保護的益處大于不良反應的風險,則可能需要推遲疫苗接種。
- 疫苗接種提供者應檢查 FDA 批準的處方信息,以獲取最完整和最新的信息,包括禁忌癥、警告和預防措施。







